sistemas termodinámicos
Termodinámica
La
Termodinámica, es la rama de la física que describe y relaciona las
propiedades físicas de la materia de los sistemas macroscópicos, así
como sus intercambios energéticos, es decir, la transformación del calor
en trabajo y viceversa. Su estudio se inició en el siglo XVIII y sus
principios se fundamentan en fenómenos comprobados experimentalmente.
Sistema termodinámico
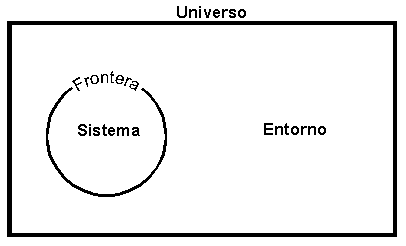
Es
alguna porción de materia que separamos del resto del Universo por
medio de un límite o frontera con el propósito de poder estudiarlo.
Paredes diatérmicas y adiabáticas
La frontera de un sistema puede estar constituida con paredes diatérmicas o con paredes adiabáticas.
Una pared diatérmica es aquella que permite la interacción térmica del sistema con los alrededores.
Los metales son materiales que constituyen excelentes paredes diatérmicas.
Una pared adiabática no permite que exista interacción térmica del sistema con los alrededores.
Los
aislantes térmicos a nivel comercial son ejemplos excelentes de
materiales con esta propiedad, como la madera, el asbesto etc.
Al
calentar agua en un matraz utilizando una flama, observamos que con el
tiempo, el agua entrará en ebullición, pues nuestro sistema (el agua),
interacciona térmicamente con los alrededores (la flama y el medio), ya
que el matraz hecho de vidrio actúa como pared diatérmica. Pero si en
lugar de calentar el agua en un matraz lo hacemos en un termo
constituido por un recipiente de doble pared y con vacío intermedio,
observaremos que no se calentará porque ahora la pared es adiabática y
no permite la interacción térmica entre la flama y el sistema.
En virtud de la naturaleza de las paredes, los sistemas termodinámicos se pueden clasificar en:
Sistema cerrado:
Tiene paredes impermeables al paso de la materia; en otras palabras, el
sistema no puede intercambiar materia con sus alrededores, y su masa
permanece constante.
Sistema abierto: Puede existir intercambio de materia o de alguna forma de energía con sus alrededores.
Sistema aislado:
No puede tener absolutamente ninguna interacción con sus alrededores;
la pared resulta impermeable a la materia y a cualquier forma de energía
mecánica o no mecánica.

Energía interna
La
energía interna de un sistema se define como la suma de las energías
cinética y potencial de las moléculas individuales que lo constituyen.
Al suministrar calor a un sistema, se provoca un aumento en la energía
de agitación de sus moléculas, se produce un incremento en la energía
interna del sistema y por consiguiente un aumento en la temperatura.
En
general, cuanto mayor sea la temperatura de un sistema, mayor será su
energía interna. Sin embargo, los valores absolutos de ésta en las
moléculas no se pueden precisar, motivo por el cual sólo se determina la
variación que sufre la energía del sistema mediante la expresión:
Ui-Uf=ΔU
Donde:
=ΔU variación de la energía interna expresada en joules (J)
=Ufenergía interna final medida en joules (J)
=Uienergía interna inicial expresada en joules (J)






 ). Sin embargo, esto desestima el hecho de que los cristales reales deben crecer en una
). Sin embargo, esto desestima el hecho de que los cristales reales deben crecer en una 





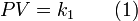

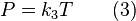
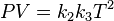

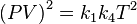
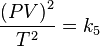
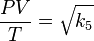
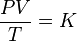
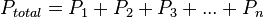 ,
,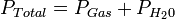 ,
,



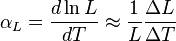
 como la letra lambda
como la letra lambda 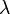 .
. o
o 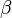 , que viene dado por la expresión:
, que viene dado por la expresión:

-
4.51
-
1
-
2
-
3
-
4
-
5
(3)