http://www.sems.udg.mx/sites/default/files/BGC/BGCUDG_C2_Fisica_II_160211_0.pdf
martes, 10 de diciembre de 2013
martes, 5 de noviembre de 2013
martes, 15 de octubre de 2013
Máquina térmica
Saltar a: navegación, búsqueda

Rotor de la turbina de vapor.
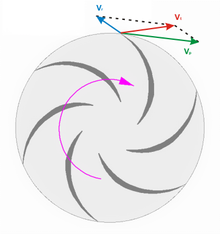
Compresor rotodinámico centrífugo y su triángulo de velocidades a la salida.
Por el contrario, en una máquina hidráulica, que es otro tipo de máquina de fluido, la variación de densidad es suficientemente pequeña como para poder desacoplar el análisis de los efectos mecánicos y el análisis de los efectos térmicos, llegando a despreciar los efectos térmicos en gran parte de los casos. Tal es el caso de una bomba hidráulica, a través de la cual pasa líquido. Alejándose de lo que indica la etimología de la palabra «hidráulica», también puede considerarse como máquina hidráulica un ventilador, pues, aunque el aire es un fluido compresible, la variación de volumen específico no es muy significativa con el propósito de que no se desprenda la capa límite.
En una máquina térmica, la compresibilidad del fluido no es despreciable y es necesario considerar su influencia en la transformación de energía.
Tercer principio de la termodinámica
Saltar a: navegación, búsqueda
El tercer principio de la termodinámica o tercera ley de la termodinámica, más adecuadamente Postulado de Nernst afirma que no se puede alcanzar el cero absoluto en un número finito de etapas. Sucintamente, puede definirse como:- Al llegar al cero absoluto, 0 K, cualquier proceso de un sistema físico se detiene.
- Al llegar al cero absoluto la entropía alcanza un valor mínimo y constante.
Un caso especial se produce en los sistemas con un único estado fundamental, como una estructura cristalina. La entropía de un cristal perfecto definida por el teorema de Nernst es cero (dado que el
 ). Sin embargo, esto desestima el hecho de que los cristales reales deben crecer en una temperatura finita y poseer una concentración
de equilibrio por defecto. Cuando se enfrían generalmente son incapaces
de alcanzar la perfección completa. Esto, por supuesto, se mantiene en
la línea de que la entropía tiende siempre a aumentar dado que ningún
proceso real es reversible.
). Sin embargo, esto desestima el hecho de que los cristales reales deben crecer en una temperatura finita y poseer una concentración
de equilibrio por defecto. Cuando se enfrían generalmente son incapaces
de alcanzar la perfección completa. Esto, por supuesto, se mantiene en
la línea de que la entropía tiende siempre a aumentar dado que ningún
proceso real es reversible.Otra aplicación de la tercera ley es con respecto al momento magnético de un material. Los metales paramagnéticos (con un momento aleatorio) se ordenarán a medida de que la temperatura se acerque a 0 K. Se podrían ordenar de manera ferromagnética (todos los momentos paralelos los unos a los otros) o de manera antiferromagné
Conclusiones DE LAS LEYES DE TERMODINAMICA
Aquí concluye el módulo. A continuación se presenta una lista con algunos de los principales puntos que deben haberse revisado a lo largo del mismo.Segunda Ley de la Termodinámica
| La segunda ley de la termodinámica es un principio general que impone restricciones a la dirección de la transferencia de calor, y a la eficiencia posible en los motores térmicos. De este modo, va más allá de las limitaciones impuestas por la primera ley de la termodinámica. Sus implicaciones se pueden visualizar en términos de la analogía con la cascada
|
|

La primera ley de la termodinámica establece que la
energía no se crea, ni se destruye, sino que se conserva. Entonces esta
ley expresa que, cuando un sistema es sometido a un ciclo termodinámico, el calor cedido por el sistema será igual al trabajo recibido por el mismo, y viceversa.
Es decir Q = W, en que Q es el calor suministrado por el sistema al medio ambiente y W el trabajo realizado por el medio ambiente al sistema durante el ciclo.
Un ejemplo sencillo seria: Al remover con un taladro el agua contenida en un recipiente, le estamos aplicando trabajo, que es igual al calor que este emite al medio ambiente al calentarse. En este caso, el sistema puede ser el agua, el medio sería el taladro, el aire circundante y todo lo que está fuera del sistema que no sea agua (pues lo que está afuera recibirá calor del sistema).

Es decir Q = W, en que Q es el calor suministrado por el sistema al medio ambiente y W el trabajo realizado por el medio ambiente al sistema durante el ciclo.
Un ejemplo sencillo seria: Al remover con un taladro el agua contenida en un recipiente, le estamos aplicando trabajo, que es igual al calor que este emite al medio ambiente al calentarse. En este caso, el sistema puede ser el agua, el medio sería el taladro, el aire circundante y todo lo que está fuera del sistema que no sea agua (pues lo que está afuera recibirá calor del sistema).

Proceso adiabático
El término adiabático hace referencia a elementos que impiden la transferencia de calor con el entorno. Una pared aislada se aproxima bastante a un límite adiabático. Otro ejemplo es la temperatura adiabática de llama, que es la temperatura que podría alcanzar una llama si no hubiera pérdida de calor hacia el entorno. En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.
En otras palabras se considera proceso adiabático a un sistema especial en el cual no se pierde ni tampoco se gana energía calorífica. Esto viene definido según la primera ley de termodinámica describiendo que Q=0
Si se relaciona el tema del proceso adiabático con las ondas, se debe tener en cuenta que el proceso o carácter adiabático solo se produce en las ondas longitudinales
sistemas termodinámicos
Termodinámica
La
Termodinámica, es la rama de la física que describe y relaciona las
propiedades físicas de la materia de los sistemas macroscópicos, así
como sus intercambios energéticos, es decir, la transformación del calor
en trabajo y viceversa. Su estudio se inició en el siglo XVIII y sus
principios se fundamentan en fenómenos comprobados experimentalmente.
Sistema termodinámico
Es
alguna porción de materia que separamos del resto del Universo por
medio de un límite o frontera con el propósito de poder estudiarlo.

Paredes diatérmicas y adiabáticas
La frontera de un sistema puede estar constituida con paredes diatérmicas o con paredes adiabáticas.
Una pared diatérmica es aquella que permite la interacción térmica del sistema con los alrededores.
Los metales son materiales que constituyen excelentes paredes diatérmicas.
Una pared adiabática no permite que exista interacción térmica del sistema con los alrededores.
Los
aislantes térmicos a nivel comercial son ejemplos excelentes de
materiales con esta propiedad, como la madera, el asbesto etc.
Al
calentar agua en un matraz utilizando una flama, observamos que con el
tiempo, el agua entrará en ebullición, pues nuestro sistema (el agua),
interacciona térmicamente con los alrededores (la flama y el medio), ya
que el matraz hecho de vidrio actúa como pared diatérmica. Pero si en
lugar de calentar el agua en un matraz lo hacemos en un termo
constituido por un recipiente de doble pared y con vacío intermedio,
observaremos que no se calentará porque ahora la pared es adiabática y
no permite la interacción térmica entre la flama y el sistema.
En virtud de la naturaleza de las paredes, los sistemas termodinámicos se pueden clasificar en:
Sistema abierto: Puede existir intercambio de materia o de alguna forma de energía con sus alrededores.
Sistema aislado: No puede tener absolutamente ninguna interacción con sus alrededores; la pared resulta impermeable a la materia y a cualquier forma de energía mecánica o no mecánica.

Energía interna
La
energía interna de un sistema se define como la suma de las energías
cinética y potencial de las moléculas individuales que lo constituyen.
Al suministrar calor a un sistema, se provoca un aumento en la energía
de agitación de sus moléculas, se produce un incremento en la energía
interna del sistema y por consiguiente un aumento en la temperatura.
En
general, cuanto mayor sea la temperatura de un sistema, mayor será su
energía interna. Sin embargo, los valores absolutos de ésta en las
moléculas no se pueden precisar, motivo por el cual sólo se determina la
variación que sufre la energía del sistema mediante la expresión:
Ui-Uf=ΔU
Donde:
=ΔU variación de la energía interna expresada en joules (J)
=Ufenergía interna final medida en joules (J)
=Uienergía interna inicial expresada en joules (J)
Ley General Del Estado Gaseoso
El volumen ocupado por la unidad de masa de un gas ideal, es directamente proporcional a su temperatura absoluta, e inversamente proporcional a la presión que se recibe.
Donde: PV =nRT o P1V1/T1=P2V2/ T2
V = volumen n = constante
P = presión
n no. de moles o gramos
R =constante
T = temperatura
R= 0.0821 (lts)(atm)/ °K mol= 8.31 °J/°K mol
EJEMPLO LEY GENERAL DEL ESTADO GASEOSO:
En un laboratorio de la Facultad de Química, había un recipiente que contenía un gas ideal que tenía una presión de 0.85 atm, un volumen de 4.7 Its y una temperatura de 25°C. Este gas se calentó hasta 120°C y se observó un aumento en su volumen hasta 23.2 Its. Determinar cúal será su presión.
En este tipo de problemas se utiliza la siguiente ecuación:
P1V1/T1= P2v2/T2
P2=P1V1T2/T1V2=(0.86 atm)(4.7 lts)(120°C)/(25°C)(23.2lts)=1.8 atm
Un tanque de 30 Its contiene un gas ideal con una masa de 5 moles a 27°C ¿A qué presión se encuentra el gas?
p=? PV=nrT
V=3OIts.
n = 5 moles P=nrT/V
T = 27°C
r=0.0821 (lts)(atm)/ °K mol
T=27+273°K=300°K
P=(5 mol)(0.082 (lts)(atm)/°K mol )(300°K ) / 30 lts = 4.105 atm
Principio de Avogadro: "Los volúmenes iguales de todos los gases y vapores bajo las mismas condiciones de presión y temperatura, contienen el mismo número de partículas'. De lo anterior se desprende que el número de moléculas contenida en una mol es una constante a la cual se conoce como el número de Avogadro: N. = 6.02472x1023 moléculas/mol
Ley general de los gases
Artículo principal: Ley de los gases ideales
Existen diversas leyes que relacionan la presión, el volumen y la temperatura de un gas.
Ley de Boyle - Mariotte
Artículo principal: Ley de Boyle-Mariotte
Cuando el volumen y la presión de una cierta cantidad de gas es mantenida a temperatura constante, el volumen será inversamente proporcional a la presión: PV=K
Leyes de los gases
Saltar a: navegación, búsqueda
Las primeras leyes de los gases
fueron desarrollados desde finales del siglo XVII, cuando los
científicos empezaron a darse cuenta de que en las relaciones entre la
presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado,
se podría obtener una fórmula que sería válida para todos los gases.
Estos se comportan de forma similar en una amplia variedad de
condiciones debido a la buena aproximación que tienen las moléculas que
se encuentran más separadas, y hoy en día la ecuación de estado para un
gas ideal se deriva de la teoría cinética.
Ahora las leyes anteriores de los gases se consideran como casos
especiales de la ecuación del gas ideal, con una o más de las variables
mantenidas constantes.Ley de Charles
Artículo principal: Ley de Charles.
La ley de Charles, o ley de los volúmenes, fue descubierta en 1778.
Se dice que, para un gas ideal a presión constante, el volumen es
directamente proporcional a la temperatura absoluta (en grados Kelvin).Esto se puede encontrar utilizando la teoría cinética de los gases o un recipiente con calentamiento o enfriamiento [sin congelar <0] con un volumen variable (por ejemplo, un frasco cónico con un globo).
Ley de Gay-Lussac
Artículo principal: Ley de Gay-Lussac.
Postula que si se mantiene constante el volumen de un gas y se
aumenta su temperatura, la presión del mismo aumenta proporcionalmente.Combinación y leyes de los gases ideales
Artículo principal: Ley general de los gases.
Ley de Boyle establece que el producto presión-volumen es constante:Mediante la combinación de (2) o (3) podemos obtener una nueva ecuación con P, V y T.
Otras leyes de los gases
- La ley de Graham establece que la velocidad de difusión de las moléculas de gas es inversamente proporcional a la raíz cuadrada de su densidad. En combinación con la ley de Avogadro (es decir, ya que los volúmenes iguales tienen el mismo número de moléculas), es lo mismo que ser inversamente proporcional a la raíz del peso molecular.
- La ley de Dalton de las presiones parciales establece que la presión de una mezcla de gases es simplemente la suma de las presiones parciales de los componentes individuales. Ley de Dalton es el siguiente:
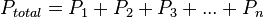 ,
,
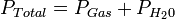 ,
,
Gases: teoría cinético molecular
La teoría cinética de los gases se enuncia en los siguientes postulados, teniendo en cuenta un gas ideal o perfecto:
1. Las sustancias están constituidas por moléculas pequeñísimas ubicadas a gran distancia entre sí; su volumen se considera despreciable en comparación con los espacios vacíos que hay entre ellas.
2. Las moléculas de un gas son totalmente independientes unas de otras, de modo que no existe atracción intermolecular alguna.
3. Las moléculas de un gas se encuentran en movimiento continuo, en forma desordenada; chocan entre sí y contra las paredes del recipiente, de modo que dan lugar a la presión del gas.
4. Los choques de las moléculas son elásticos, no hay pérdida ni ganancia de energía cinética, aunque puede existir transferencia de energía entre las moléculas que chocan.
5. La energía cinética media de las moléculas es directamente proporcional a la temperatura absoluta del gas; se considera nula en el cero absoluto.
Los gases reales existen, tienen volumen y fuerzas de atracción entre sus moléculas. Además, pueden tener comportamiento de gases ideales en determinadas condiciones: temperaturas altas y presiones muy bajas
Modelo corpuscular
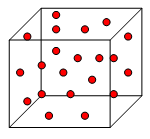 |
Un modelo corpuscular para gases
|
Dicho modelo, debe ser el más elemental posible, debe explicar las propiedades observadas en los gases, debe contemplar la existencia de partículas muy pequeñas, de tamaño despreciable frente al volumen total, dotadas de grandes velocidades en constante movimiento caótico, chocando entre sí o con las paredes del recipiente. En cada choque se supone que no hay pérdida de energía y que no existe ningún tipo de unión entre las partículas que forman el gas.
Así, el concepto de presión, estará ligado al de los choques de las partículas sobre las paredes, debido al movimiento que llevan, presión que se ejerce sobre todas las direcciones, no existiendo direcciones privilegiadas. Así, cuantos más choques se produzcan, mayor es la presión del gas.
La temperatura, indicará la energía cinética media de las partículas: si la temperatura de un gas es superior a otro, sus partículas por término medio, poseen mayor velocidad.
Gas ideal
Saltar a: navegación, búsqueda
Un gas ideal es un gas teórico compuesto de un conjunto de partículas puntuales
con desplazamiento aleatorio que no interactúan entre sí. El concepto
de gas ideal es útil porque el mismo se comporta según la ley de los gases ideales, una ecuación de estado simplificada, y que puede ser analizada mediante la mecánica estadística.En condiciones normales tales como condiciones normales de presión y temperatura, la mayoría de los gases reales se comporta en forma cualitativa como un gas ideal. Muchos gases tales como el nitrógeno, oxígeno, hidrógeno, gases nobles, y algunos gases pesados tales como el dióxido de carbono pueden ser tratados como gases ideales dentro de una tolerancia razonable.1 Generalmente, el apartamiento de las condiciones de gas ideal tiende a ser menor a mayores temperaturas y a menor densidad (o sea a menor presión),1 ya que el trabajo realizado por las fuerzas intermoleculares es menos importante comparado con energía cinética de las partículas, y el tamaño de las moléculas es menos importante comparado con el espacio vacío entre ellas.
El modelo de gas ideal tiende a fallar a temperaturas menores o a presiones elevadas, cuando las fuerzas intermoleculares y el tamaño intermolecular es importante. También por lo general, el modelo de gas ideal no es apropiado para la mayoría de los gases pesados, tales como vapor de agua o muchos fluidos refrigerantes.1 A ciertas temperaturas bajas y a alta presión, los gases reales sufren una transición de fase, tales como a un líquido o a un sólido. El modelo de un gas ideal, sin embargo, no describe o permite las transiciones de fase. Estos fenómenos deben ser modelados por ecuaciones de estado más complejas.
El modelo de gas ideal ha sido investigado tanto en el ámbito de la dinámica newtoniana (como por ejemplo en "teoría cinética") y en mecánica cuántica (como "partícula en una caja"). El modelo de gas ideal también ha sido utilizado para modelar el comportamiento de electrones dentro de un metal (en el Modelo de Drude y en el modelo de electrón libre), y es uno de los modelos más importantes utilizados en la mecánica estadística.
GASES denomina gas al estado de agregación de la materia
en el cual, bajo ciertas condiciones de temperatura y presión, sus
moléculas intereaccionan solo débilmente entre sí, sin formar enlaces
moleculares, adoptando la forma y el volumen del recipiente que las
contiene y tendiendo a separarse, esto es, expandirse, todo lo posible
por su alta energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad
con la presión y la temperatura. Las moléculas que constituyen un gas
casi no son atraídas unas por otras, por lo que se mueven en el vacío a
gran velocidad y muy separadas unas de otras, explicando así las
propiedades:
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.
Capacidad calorífica
La capacidad calorífica no debe ser confundida con la capacidad calorífica específica o calor específico, el cual es la propiedad intensiva que se refiere a la capacidad de un cuerpo «para almacenar calor»,2 y es el cociente entre la capacidad calorífica y la masa del objeto. El calor específico es una propiedad característica de las sustancias y depende de las mismas variables que la capacidad calorífica.1
CALENTAMIENTOUn fenómeno físico consistente en un aumento de la temperatura
EL CALENTAMIENTO
ð Definición:
Consiste en los movimientos previos que se realizan antes de un esfuerzo físico. Hay que predisponer a nuestro cuerpo para poder desarrollar una actividad superior a la que realizamos normalmente. Por lo tanto, ante la práctica de cualquier deporte o ejercicio es imprescindible realizarlo. Incluso en profesiones de mayor desgaste sería imprescindible, pero habitualmente no se efectúa. Lo que conlleva muchas lesiones articulares, tendinosas y musculares.
ð Objetivos del calentamiento.
Mejora la excitabilidad muscular, ya que los estímulos son de leve intensidad al principio y no producen ningún estrés funcional, por lo que el músculo a medida que las contracciones y estiramientos musculares dan lugar al aumento de calor, se ve predisposición al aumento de la intensidad de las cargas, así como el comienzo de la utilización de las reservas enérgicas existentes a nivel muscular y el transporte de O2 y desechos. Ya que entra en un aceptable rendimiento el circuito de riego sanguíneo.En lo En lo que coinciden la mayoría de los especialistas es en el aumento De la temperatura que se produce a nivel muscular, favoreciéndose todas las reacciones bioquímicas que se producen, disminuyéndose el riesgo de lesiones, aumentándose la elasticidad muscular y la velocidad de contracción.
EFECTOS DEL CALENTAMIENTO EN EL ORGANISMO
Aumento de la frecuencia y amplitud de la respiración:
Cuando el organismo alcanza una temperatura media de 38'5-39 ºC, el equivalente respiratorio (relación entre ventilación y consumo de O2: VE/VO2) es más favorable y se consigue el consumo máximo de O2. El ajuste respiratorio acusa un retraso al inicio del ejercicio. Después, la ventilación alcanza un estado estable. Lo que pretende el calentamiento es llegar antes a este estado estable ("steady state"), por medio de un aumento del volumen de la ventilación.
NOTA: El "dolor de costado" se da por una subalimentación de O2 del diafragma (el cual juega un papel importante en la respiración abdominal) lo que provoca una acidosis local elevada,esta produce el "dolor de costado".
Reducción de la viscosidad muscular:
Unos 15-20 minutos de carrera lenta eleva la temperatura corporal a 38´5 ºC aproximadamente. Esta temperatura es la necesaria para reducir la viscosidad del músculo (el roce de las fibras musculares entre sí) y aumenta la elasticidad, lo que tiene como resultado un mejor rendimiento y evita posibles lesiones.
Mejora de la alimentación de E (energía) y de O2:
La elevación de la temperatura implica una disociación más rápida del O2 fijado en la sangre por la hemoglobina. La mejora de la alimentación de substratos energéticos (glucosa, aminoácidos -aa- y ácidos grasos) se da por un aumento de la degradación selectiva en el músculo de fuentes de energía y por el aumento de la irrigación sanguínea en los músculos.
Aumento de la temperatura corporal:
Es debido a las reacciones metabólicas que se dan en el organismo. Las reacciones químicas que se dan en el organismo liberan energía que aumenta la temperatura. Este aumento en exceso puede ser perjudicial porque puede desnaturalizar las células. El cuerpo humano dispone de varios mecanismos para liberarse de esta excesiva temperatura: sudoración…
Mejora de procesos neuromusculares:
La reducción de la viscosidad mejora la cooperación neuromuscular y la coordinación motriz lo que reduce las necesidades de substratos energéticos y la fatiga. Conjuntamente a la reducción de viscosidad se da el aumento de la temperatura, lo que provoca una aumento de la velocidad del sistema nervioso y mejora la sensibilidad de los receptores propioceptivos.
EL CALENTAMIENTO
ð Definición:
Consiste en los movimientos previos que se realizan antes de un esfuerzo físico. Hay que predisponer a nuestro cuerpo para poder desarrollar una actividad superior a la que realizamos normalmente. Por lo tanto, ante la práctica de cualquier deporte o ejercicio es imprescindible realizarlo. Incluso en profesiones de mayor desgaste sería imprescindible, pero habitualmente no se efectúa. Lo que conlleva muchas lesiones articulares, tendinosas y musculares.
ð Objetivos del calentamiento.
Mejora la excitabilidad muscular, ya que los estímulos son de leve intensidad al principio y no producen ningún estrés funcional, por lo que el músculo a medida que las contracciones y estiramientos musculares dan lugar al aumento de calor, se ve predisposición al aumento de la intensidad de las cargas, así como el comienzo de la utilización de las reservas enérgicas existentes a nivel muscular y el transporte de O2 y desechos. Ya que entra en un aceptable rendimiento el circuito de riego sanguíneo.En lo En lo que coinciden la mayoría de los especialistas es en el aumento De la temperatura que se produce a nivel muscular, favoreciéndose todas las reacciones bioquímicas que se producen, disminuyéndose el riesgo de lesiones, aumentándose la elasticidad muscular y la velocidad de contracción.
EFECTOS DEL CALENTAMIENTO EN EL ORGANISMO
- Intensificación de la circulación sanguínea: que viene dada por 3 factores:
- Aumento de la frecuencia cardíaca (fc): Se da una estimulación debido a la excitación de la Adrenalina.
- Aumento de la presión sanguínea: Las glándulas suprarrenales producen Adrenalina y Noradrenalina. La Noradrenalina produce una vasoconstricción periférica (vasos sanguíneos cutáneos disminuyen su diámetro y así los músculos reciben más sangre). Debido a este aumento de la sangre en el músculo, aumento de la frecuencia cardíaca y aumento de la resistencia periférica, se da un aumento de la presión sanguínea (se dilatan las arterias que dan sangre al músculo para compensar este aumento de presión).
- Aumento del volumen sanguíneo en circulación: Este permite llevar más sustratos y O2 hacia los músculos y eliminar los desechos. Así se evita una hiperacidosis del músculo (descenso del pH) que puede alterar su actividad, desnaturalizando las células.
Cuando el organismo alcanza una temperatura media de 38'5-39 ºC, el equivalente respiratorio (relación entre ventilación y consumo de O2: VE/VO2) es más favorable y se consigue el consumo máximo de O2. El ajuste respiratorio acusa un retraso al inicio del ejercicio. Después, la ventilación alcanza un estado estable. Lo que pretende el calentamiento es llegar antes a este estado estable ("steady state"), por medio de un aumento del volumen de la ventilación.
NOTA: El "dolor de costado" se da por una subalimentación de O2 del diafragma (el cual juega un papel importante en la respiración abdominal) lo que provoca una acidosis local elevada,esta produce el "dolor de costado".
Unos 15-20 minutos de carrera lenta eleva la temperatura corporal a 38´5 ºC aproximadamente. Esta temperatura es la necesaria para reducir la viscosidad del músculo (el roce de las fibras musculares entre sí) y aumenta la elasticidad, lo que tiene como resultado un mejor rendimiento y evita posibles lesiones.
La elevación de la temperatura implica una disociación más rápida del O2 fijado en la sangre por la hemoglobina. La mejora de la alimentación de substratos energéticos (glucosa, aminoácidos -aa- y ácidos grasos) se da por un aumento de la degradación selectiva en el músculo de fuentes de energía y por el aumento de la irrigación sanguínea en los músculos.
Es debido a las reacciones metabólicas que se dan en el organismo. Las reacciones químicas que se dan en el organismo liberan energía que aumenta la temperatura. Este aumento en exceso puede ser perjudicial porque puede desnaturalizar las células. El cuerpo humano dispone de varios mecanismos para liberarse de esta excesiva temperatura: sudoración…
La reducción de la viscosidad mejora la cooperación neuromuscular y la coordinación motriz lo que reduce las necesidades de substratos energéticos y la fatiga. Conjuntamente a la reducción de viscosidad se da el aumento de la temperatura, lo que provoca una aumento de la velocidad del sistema nervioso y mejora la sensibilidad de los receptores propioceptivos.
Calor latente
Saltar a: navegación, búsqueda
El calor latente es la energía requerida por una cantidad de sustancia para cambiar de fase, de sólido a líquido
(calor de fusión) o de líquido a gaseoso (calor de vaporización).Se
debe tener en cuenta que esta energía en forma de calor se invierte para
el cambio de fase y no para un aumento de la temperatura.Antiguamente se usaba la expresión calor latente para referirse al calor de fusión o de vaporización. Latente en latín quiere decir escondido, y se llamaba así porque, al no notarse un cambio de temperatura mientras se produce el cambio de fase (a pesar de añadir calor), éste se quedaba escondido. La idea proviene de la época en la que se creía que el calor era una sustancia fluida denominada calórico. Por el contrario, el calor que se aplica cuando la sustancia no cambia de fase, aumenta la temperatura y se llama calor sensible.
Cuando se aplica calor al hielo, va ascendiendo su temperatura hasta que llega a 0 °C (temperatura de cambio de fase), a partir de entonces, aun cuando se le siga aplicando calor, la temperatura no cambia hasta que se haya fundido del todo. Esto se debe a que el calor se emplea en la fusión del hielo.
Una vez fundido el hielo la temperatura volverá a subir hasta llegar a 100 °C; desde ese momento se mantendrá estable hasta que se evapore toda el agua.
Esta cualidad se utiliza en la cocina, en refrigeración, en bombas de calor y es el principio por el que el sudor enfría el cuerpo.
Cambios De Fase Y Calentamiento
FISICA
Capacidad calorífica
La capacidad calorífica de un cuerpo es el cociente entre la cantidad de energía calorífica transferida a un cuerpo o sistema en un proceso cualquiera y el cambio de temperatura que experimenta. En una forma menos formal es la energía necesaria para aumentar 1 K la temperatura de una determinada cantidad de una sustancia, (usando el SI).[] Indica la mayor o menor dificultad que presenta dicho cuerpo para experimentar cambios de temperatura bajo el suministro de calor. Puede interpretarse como una medida de inercia térmica. Es una propiedad extensiva, ya que su magnitud depende, no solo de la sustancia, sino también de la cantidad de materia del cuerpo o sistema; por ello, es característica de un cuerpo o sistema particular. Por ejemplo, la capacidad calorífica del agua de una piscina olímpica será mayor que la de un vaso de agua. En general, la capacidad calorífica depende además de la temperatura y de la presión.
La capacidad calorífica no debe ser confundida con la capacidad calorífica específica o calor específico, el cual es la propiedad intensiva que se refiere a la capacidad de un cuerpo «para almacenar calor»,[] y es el cociente entre la capacidad calorífica y la masa del objeto. El calor específico es una propiedad característica de las sustancias y depende de las mismas variables que la capacidad calorífica.[]
Calor especifico
CALOR ESPECÍFICO, CANTIDAD DE CALOR: GANADO O PERDIDO (EQUILIBRIO TERMICO)
La capacidad calorífica de una sustancia es la relación entre el calor recibido y su variación de temperatura; si calentamos diferentes masas de una misma sustancia, observamos que su capacidad calorífica es distinta. Por ejemplo, al calentar dos trozos de hierro, uno de dos kilogramos y otro de diez kilogramos, la relación ∆Q/∆T= C es diferente entre los dos trozos, aunque se trata de la misma sustancia.
Dilatación irregular del agua – Física 2
28 mar
Como
los líquidos toman la forma del recipiente que los contiene, no se
puede hablar que exista dilatación lineal o dilatación superficial.
Estamos ante un caso de dilatación volumétrica y debemos considerar una
dilatación total.

Como
caso especial, tenemos al agua, ya que cuando se encuentra a
temperaturas cercanas a su punto de congelación (0 °C), ya que con un
incremento pequeño de temperatura esta se contrae y el proceso continúa
hasta el omento justo en que alcanza 4°C.
Si
la temperatura sigue aumentando, entonces le agua empieza a dilatarse
en forma continua hasta el momento en que alcanza su punto de
ebullición, el cual corresponde a 100°C.
Por
la estructura cristalina del agua, esta aumenta de volumen por debajo
de 0°C, y como es hielo macizo, al tener una mayor densidad que el agua,
flota, tal y como se puede observar en los polos de la tierra.
Esto
es de mucha importancia, ya que en las zonas geográficas de baja
temperatura los lagos y mares tienden a congelarse en la superficie,
esta capa sirve como protección para que la vida en el interior siga su
ritmo, ya que conserva una temperatura adecuada para la fauna marina.

Coeficientes de dilatación
De forma general, durante una transferencia de calor, la energía que está almacenada en los enlaces intermoleculares entre dos átomos cambia. Cuando la energía almacenada aumenta, también lo hace la longitud de estos enlaces. Así, los sólidos normalmente se expanden al calentarse y se contraen al enfriarse;1 este comportamiento de respuesta ante la temperatura se expresa mediante el coeficiente de dilatación térmica (típicamente expresado en unidades de °C-1):Sólidos
Para sólidos, el tipo de coeficiente de dilatación más comúnmente usado es el coeficiente de dilatación lineal αL. Para una dimensión lineal cualquiera, se puede medir experimentalmente comparando el valor de dicha magnitud antes y después de cierto cambio de temperatura, como:Puede ser usada para abreviar este coeficiente, tanto la letra griega alfa
 como la letra lambda
como la letra lambda 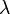 .
.Térmica
Dilatación, por lo general, la materia se dilata al calentar y se contrae al enfriarla. Esta dilatación se supone que "a" no depende de la temperatura lo cual no es estrictamente cierto.Se denomina dilatación térmica al aumento de longitud, volumen o alguna otra dimensión métrica que sufre un cuerpo físico debido al aumento de temperatura que se provoca en él por cualquier medio.Gases y líquidos
En gases y líquidos es más común usar el coeficiente de dilatación volumétrico o
o 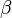 , que viene dado por la expresión:
, que viene dado por la expresión:Para sólidos, también puede medirse la dilatación térmica, aunque resulta menos importante en la mayoría de aplicaciones técnicas. A partir del cálculo se deduce que el coeficiente de dilatación volumétrico es el triple del coeficiente de dilatación lineal, por lo tanto, para los rangos donde el coeficiente es constante se cumple:
| Glicerina | 0,51 |
| Mercurio | 0,18 |
| Agua | 0,21 |
Suscribirse a:
Comentarios (Atom)









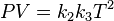

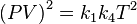
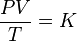

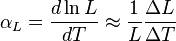


-
4.51
-
1
-
2
-
3
-
4
-
5
(3)